最新フッ素関連トピックス」はダイキン工業株式会社ファインケミカル部のご好意により、ダイキン工業ホームページのWEBマガジンに掲載された内容を紹介しています。ご愛顧のほどよろしくお願いいたします。尚、WEBマガジンのURLは下記の通りです。
http://www.daikin.co.jp/chm/products/fine/backnum/201201/
1、はじめに
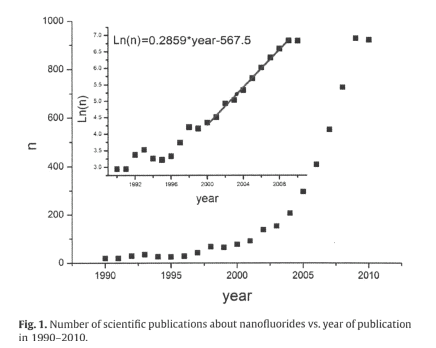
無機フルオライドはこれまで工業的には、アルミニウム、ジルコニウム、レアメタルなどの精錬、ウラニウムの同位体分離、固体レーザーや反射防止コート、光ファイバーなどの光学用途に使われてきた。最近では、フルオライド化合物のナノケミストリーが注目されている。ここでは、ロシアのPavel P. Fedorov らの総説を中心の無機ナノフルオライドについて概説するが、その冒頭で述べているように、2000年から2009年にかけてのナノフルオライドに関する文献の数が対数的に増加していることからもそのことが如実に示されている。1)
2、無機ナノフルオライドの合成法
ナノフルオライドの合成法については、物理的、化学的方法があるが、ボールミルや超音波処理、マイクロ波併用の熱処理などの物理的方法は化学的な方法を必ずともなうので、ここでは化学的方法をいくつか取り上げていく。
合成法の骨子は、無機化合物(硝酸塩や塩化物など)をフッ素化して粒子径が10~100nmのナノフルオライドを作製することである。以下に各種合成を列挙する。
2.1.前駆物質の熱分解
前駆物質として、M(CF3COO)nが最も一般的である。典型的な熱分解プロセスは、オレイン酸などの高沸点溶媒とM(CF3COO)nを微量酸素および水を除去すべく100℃真空中で激しく攪拌し、さらにアルゴン雰囲気下、250~330℃に熱する。次いで、室温で過剰のエタノールを加えて反応を終了させる。沈殿物を遠心分離で液相から分離し、エタノールで数回洗浄し、70℃空気中で乾燥する。合成されたナノフルオライドはヘキサンやトルエン、クロロホルムなどの有機溶媒に容易に分散する。この方法で、MF2(M=Mg、Ca、Sr)やRF3、LiRF3、NaRF3(Rは希土類)、NaMF3(M=Mn、Co、Ni、Mg)、α-、β-NaYF4などが合成されている。
2.2.水溶液からの共沈
一般的な工程としては、フッ素化反応終了後、ナノフルオライドのナノ粒子水溶液にNaFなどを添加して、共沈させる。その後、エージングし、水やNH4HF2、メタノールで洗浄し、乾燥する、最後にアルゴン-SF6(9:1)などの雰囲気で高温で熱する。この場合、EDTAなどの有機化合物を加えて、ナノ粒子の表面を安定化することも行われている。本法で、例えばCeF3、EuF3ナノフルオライドが合成されている。
2.3.逆ミセルとマイクロエマルション沈殿
ここでは、最近の一例があげられている。ホスフィンオキサイドからなる抽出剤Cyanex923を含むn-ヘプタン溶液とNd(NO3)3水溶液を攪拌し、遠心分離により分離する(この場合、WO型逆ミセルあるいはマイクロエマルションができている)。次いでNH4Fと界面活性剤溶液に滴として注ぎ、超音波をかける。さらに遠心分離後、脱イオン化水とアセトンで洗浄し、真空乾燥して、NdF3ナノフルオライドを得た。
2.4.水熱合成
これは無機化合物が高温の水によく溶けることを利用した方法であり、有機溶媒を用いないことが特徴。反応温度(通常120℃から230℃)、PHや濃度さらにはオートクレーブの構造などを選定する必要がある。例えば、希土類の硝酸塩とNH4Fとを120℃~180℃の温度、pH=3~4.5の条件で反応させてRF3希土類のナノフルオライドを合成している。
2.5.非水溶媒熱合成
この方法は、非水溶媒を用いて高温で反応させる方法であり、酸素のコンタミを防ぎ、安定な表面を作り、凝集を防ぐことができる特徴がある。溶媒として、ジエチレングリコールなどが用いられ、ポリアクリル酸などの界面活性剤などが補助剤として使われることもある。CaF2、CeF2、CeF2:Tb3+などの合成例がある。
2.6.ゾル・ゲル法
古来のゾル・ゲル法は、前駆物質の溶液の合成、ゾルへの転化、そして、ゲルへの転化を経て、焼成、熱処理から成る。最近では、このステップの一部が欠けるプロセスも提案されている。化学反応はゲルへの転化工程で起こる。ゾル・ゲル法では、粒子の形やサイズのコントロールが難しく、粒子が単分散ではない。また、粒子の表面積が大きい例が多々ある。Al(OiPr)3のiPrOH溶液をアルコール系HFで処理後、溶媒を除去しながらゲル化するとAl-F-ゲルが生成する例が紹介されている。
2.7.その他の方法
上記の方法以外に、メカノケミストリー法、望みの形やサイズを作るためのマトリックスとして鋳型を用いる固体テンプレート合成法、溶融塩を利用するフラックス法、ガラス・セラミックスの酸腐食処理法などの方法が述べられている。
3、ナノケミカル効果
ナノ粒子は極めて高い表面積を有するので、高い化学活性を示す。そのことは、超強酸であったり、高い触媒活性だったりするが、熱分解性が高いとか水分や酸素の影響を受けやすいなどの負の特徴につながっている。
ナノ粒子は凝集しやすいが、そのために自己組織化して層を形成しやすい。その結果、超格子を形成できる場合がある。例えば、R(CF3COO)3をオレイン酸/t-オクタデカン/オレイルアミン中で熱分解してRF3とする場合などである。また、結晶成長は可干渉相間成長のような非古典的な機構で起こる。(ここでRは希土類)
フルオライド・ナノケミストリーの最大の特徴は、その合成の経路において非平衡相を形成することである。例えば、AlF3が非晶質状態から安定な三方晶形を形成する過程で非平衡状態の正方晶形を通ること、CaF2-RF3が非平衡状態の固体溶液状態として存在することなどが述べられている。非平衡状態から平衡状態への転換にはエネルギーバリアがあり、温度や時間をかけたり、触媒などを使う方法が述べられている。
物理化学的特徴としては、融点が低い、イオン導電性が高い、カチオン移動度が高いなどがある。
4、形とサイズの制御
ナノフルオライドのサイズや形態は、反応温度や時間、使用溶媒によって影響を受ける。また、塩酸や硝酸の添加、超音波照射、などの影響も受け、一次元、二次元、三次元の場合に分けて述べられている。
5、表面の修正とコア/シェル機構
ナノフルオライドの表面にシェルを形成し、表面を修正する方法が述べられている。例えば、MF2ナノ結晶体をオレイン酸で被覆し、疎水性粒子としての機能を発揮させ、また凝集を防ぐことができるなどの機能を持たせている。
6、ナノコンポジット
ガラスマトリックスの中にナノ粒子が分散した透明なナノコンポジットがよく知られている。例えば、50SiO2-30Al2O3-20CaF2/15-60nmCaF2:Sm3+やなどのアルミノシリケートがメインである。ここで、CaF2:Sm3+はSm3+がドープされたCaF2ナノ粒子である。核形成剤としてNiOなどが用いられることもある。また、ナノ粒子のサイズは温度や時間により変化する。
7、応用
ナノフルオライドは優れた発光原子団で、ナノシンチレーター、高解像度のカラーディスプレイ、白色発光デバイス、監視装置、ガン治療薬などに適用できる。
ナノフルオライドのコロイド溶液は人体中で安定で、広範囲のバイオ医療用途で期待される。例えば、MRIやCTスキャンにおいて常磁性のコントラスト剤が使われるが、クエン酸をコートしたGdF3-CeF3やポリアクリル酸をコートしたNaGdF4などのナノフルオライドが期待されている。また、乳がん細胞の優れた標識としてTb3+をドープしたGdF3ナノフルオライドが報告されている。2)
MgF2やAlF3のナノフルオライドはビタミンEやKの高活性・高選択性の不均一系触媒である。
8、おわりに
無機のナノフルオライドについて述べてきたが、図1にも示したようにこの10年間に文献の数は飛躍的に伸びていて、高い関心が示されている。特に希土類ナノフルオライドは優れた発光原子団などとして、エレクトロニクス、バイオの領域で期待されており、今後の動向が注目される。
文献
1) Pavel P. Fedorov et al J. of Fluorine Chemistry 132(2011) 1012-1039
2)A.K. Tyagi et al J. of Colloid and Interface Science in press 2011